江门市五邑中医院医学伦理委员会简介
一、概况
我院医学伦理委员会成立于2006年,为了保证药物临床试验过程的规范和保护受试者的权益和安全而独立行使伦理审查职责,2017年3月顺利通过国家食品药品监督管理局(CFDA)组织的 “药物临床试验机构资格认定”(伦理委员会)现场检查。2018年11月,我院成为广东省药学会药物临床试验伦理审查联盟成员单位。
医学伦理委员会旨在为本院承担的或本院实施的新药、医疗器械、体外诊断试剂等注册类临床研究、其他涉及人的生物医学研究、本院开展的医疗新技术等项目进行科学性、伦理合理性审查,旨在保证受试者的尊严、安全和权益,促进生物医学科学健康地发展,增强公众的信任和支持。
二、 伦理委员会组成
我院医学伦理委员会委员共14人,专职伦理秘书1人,委员会委员由多学科背景的人员组成,包括从事医药相关专业人员、非医药专业人员、法律专家,以及独立于研究/试验单位之外的人员,男女委员比例适当,确保伦理委员有资格和经验共同对试验的科学性及伦理性进行审阅和评估。
三、 伦理委员会职责与审查范围
1、伦理委员会遵守国家宪法,根据《药物临床试验质量管理规范》(2003)、《药物临床试验伦理审查工作指导原则》(2010)、《涉及人的生物医学研究伦理审查办法》(2016)、《中医药临床研究伦理审查管理规范》(2010)、《医疗器械临床试验质量管理规范》(2016)、《体外诊断试剂临床试验技术指导原则》(2014)、赫尔辛基宣言(2013)、CIOMS人体生物医学研究国际伦理指南(2016)等法规规范要求独立开展伦理审查工作。
2、审查范围:对于所有涉及人的研究,在申报之前需要进行伦理审查,具体包括以下几类:
(1)I期临床试验;
(2)医疗器械临床试验;
(3)体外诊断试剂;
(4)本院开展的医疗新技术新项目;
3、会议时间:每月固定召开1次审查会议,时间为最后一周周四下午(实际时间以当月安排为准,可联系伦理秘书确认),如需进行伦理审查,必须于开会前一周交齐所有纸质材料。
四、会议时间
每月固定召开1次审查会议,时间为最后一周周四下午(实际时间以当月安排为准,可联系伦理秘书确认),如需进行伦理审查,必须于开会前一周交齐所有纸质材料。
五、联系方式
联系人:李立斌(伦理秘书)
电话:0750-3509641 18575002520
Email:wyzyykjk@126.com
地址:江门市蓬江区华园东路30号江门市五邑中医院12号楼8楼803
六、相关文件下载 (打包下载)
3.主要研究者简历
6.修订说明函
7.SAE报告表
9.暂停终止研究报告
10.研究进展报告
11.研究完成报告表
12.伦理复审申请表
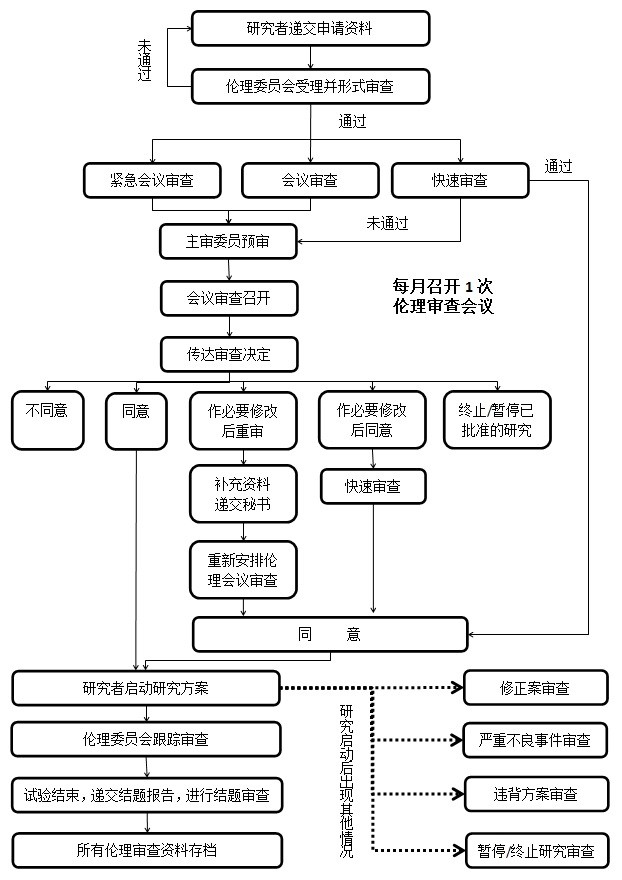
七、伦理审查流程图